Le célèbre poème de Samuel Coleridge “Le temps de l’ancien marin‘ a cité : ‘De l’eau, de l’eau partout, ni une goutte à boire !’ À travers ces lignes célèbres, Coleridge indiquait qu’il n’avait pas d’eau à consommer bien qu’il soit entouré d’un océan. Il a également mentionné qu’il avait tué un albatros (ce qui, selon la tradition locale, porte malheur à tous à bord du navire). Bien entendu, à travers ses célèbres lignes, il réaffirme également le savoir commun selon lequel 75 % de la surface terrestre est constituée d’eau. De plus, nous savons également que 60 % du corps humain est constitué d’eau. Ainsi, l’eau (une simple molécule) s’avère cruciale dans tous les processus.
Pour que les étudiants en apprennent davantage sur ce phénomène connu (en détail), les professeurs de chimie des collèges donnent des devoirs sur les propriétés chimiques du H2O, sa structure, son importance environnementale, etc. afin de déterminer leur profondeur de compréhension. Cependant, les étudiants, qui ne connaissent pas bien les propriétés chimiques, la structure et la signification globale, ont souvent du mal à rédiger des articles bien documentés et uniques dans des délais serrés. Heureusement, plusieurs sites Web notables de tutorat par devoirs (comme TopAide aux devoirs) proposent une aide aux devoirs de chimie à 360 degrés sur des sujets de base et avancés.
Leur tutorat personnalisé permet aux étudiants d’accroître leurs connaissances sur le sujet/concept, d’améliorer leurs compétences en rédaction académique et de préparer des articles dignes d’être soumis pour d’excellentes notes. Vous pouvez l’essayer si vous rencontrez des difficultés similaires dans la compréhension de sujets de chimie spécifiques inclus dans leur programme.
Néanmoins, ci-dessous, nous expliquons lucidement tout ce qui concerne la couverture du titre pour vous aider à démarrer vos devoirs.
Les propriétés chimiques de l’eau
Étant une substance chimique, (H2O) réagit avec de nombreuses substances pour former divers composés chimiques.
Réaction rédox: En tant que merveilleuse source d’hydrogène (ayant 2 atomes d’hydrogène liés de manière covalente à un atome d’oxygène), les éléments électropositifs diminuent les molécules d’hydrogène.
Pendant la photosynthèse, H2O est réduit et oxydé en O2, s’avérant ainsi vital pour les réactions redox. (Voir l’exemple)
![]()
Atmosphérique par nature: Beaucoup savent peut-être que H2O peut servir de base et d’acide. Cela indique que, par nature, il est atmosphérique. (Voir l’exemple)
Comportement acide :
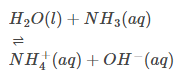
Comportement de base :
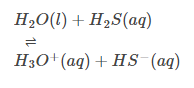 Réaction d’hydrolyse: Il présente également une forte tendance hydratante principalement due à sa constante diélectrique et peut dissoudre plusieurs composés emblématiques. Certains composés ioniques et covalents peuvent être hydrolysés.
Réaction d’hydrolyse: Il présente également une forte tendance hydratante principalement due à sa constante diélectrique et peut dissoudre plusieurs composés emblématiques. Certains composés ioniques et covalents peuvent être hydrolysés.
Sécurisé aide aux devoirs au collège sur TopHomeworkHelper.com et obtenez un accès gratuit à de nombreuses solutions de réponses/notes d’écriture en chimie.
En savoir plus sur les propriétés H2O
- Masse molaire – 8,01528(33) g/mol
- Densité solide – 0,9167 g/ml à 0 °C
- Densité du liquide – 0,961893 g/mL à 95 °C, 0,9970474 g/mL à 25 °C, 0,9998396 g/mL à 0 °C
- Point de fusion – 0 degré C
- Point d’ébullition – 100 degrés C
- Acidité – 13.995
- Pression de vapeur – 0,032176 atm/3,1690 kilopascals
- Viscosité – 0,890 cP
- Conductivité thermique –0,6065 W/m·K
- Indice de réfraction – 1,3330 (nD)
- Basicité – 13,995 (pKo)
La chimie de la structure de l’eau
La structure chimique de l’eau est constituée de 2 atomes d’hydrogène différents liés à un seul atome d’oxygène. En raison de l’électronégativité plus élevée des atomes d’oxygène, il possède des liaisons covalentes polaires. Contrairement aux atomes d’hydrogène, l’atome d’oxygène attire davantage les électrons partagés des liaisons covalentes. Par conséquent, les atomes d’oxygène sont chargés négativement (partiellement) tandis que les atomes d’hydrogène reçoivent une charge partielle positive. Les atomes adoptent alors une structure courbée en raison de 2 paires d’électrons libres sur l’atome d’oxygène. La forme courbée de la molécule d’eau est due au fait que les liaisons polaires O – H ne s’annulent pas et que la molécule entière est polaire.
De plus, les liaisons polaires s’attirent mutuellement grâce aux forces dipolaire-dipôle (l’extrémité positive d’une molécule est attirée par l’extrémité négative de la molécule voisine). Dans l’eau, les liaisons polaires O – H ont une faible densité électronique à proximité des atomes d’hydrogène, chaque atome H2 étant attiré par les électrons solitaires d’un atome O adjacent. C’est ce qu’on appelle les liaisons hydrogène, et elles sont plus fortes que toutes les forces dipolaires normales.
Importance environnementale
Avec une population mondiale en plein essor chaque année, l’importance environnementale et la demande en eau utilisable augmentent également.
L’eau est également importante pour nourrir, faire pousser et entretenir diverses plantes et animaux (même pour le déplacement et la reproduction des poissons). Les arrosages de routine des plantes à fleurs fournissent également de la nourriture et un abri aux insectes, aux reptiles, aux grenouilles et aux mammifères. Même les oiseaux des bois réagissent bien aux zones humides saines. Ils peuvent facilement se nourrir et se déplacer pour polliniser les plantes et réguler les insectes et les ravageurs.
Le public doit reconnaître la valeur de l’eau avec une plus grande importance. L’eau potable est cruciale pour l’agriculture, l’élevage, l’assainissement et le maintien de l’écosystème environnant. L’eau aide à restaurer et à maintenir le débit naturel des rivières, des zones humides, des ruisseaux, etc. et contribue à soutenir les habitats des plaines inondables.
Il est donc important que le gouvernement mondial et les autres organismes officiels responsables maintiennent un système d’approvisionnement en eau sain, renouvelable et résilient, pour le bénéfice de tous.
Source: La chimie de l’eau : propriétés, structure et importance environnementale